Sono passati quarant’anni da quando venne identificato per la prima volta il virus dell’HIV. Di passi in avanti da allora ne sono stati fatti parecchi. Tutti fuorché uno: trovare un vaccino capace di prevenire l’infezione. L’ultima sperimentazione avanzata è fallita a seguito dei risultati deludenti ottenuti nei test clinici. Per gli osservatori si tratta di un passo indietro per la ricerca di almeno dieci anni. Quello dei vaccini è un argomento cruciale quando si parla di malattie infettive. Lo si è visto di recente con la pandemia da Covid-19. In quel caso una soluzione è stata trovata in meno di un anno, mentre per l’infezione da HIV si attende ormai da troppo tempo. Per quale motivo? «È difficile dare una risposta», riflette Guido Poli, Professore Ordinario di Patologia Generale presso l’Università Vita-Salute San Raffaele di Milano: «Nella scienza si dice che non è mai possibile provare il negativo, cioè non è mai possibile dimostrare perché qualcosa non funziona o non fa un effetto».
Il fallimento del test “Mosaico”
L’ultimo fallimento è stato annunciato a pochi giorni dall’inizio del 2023. Nello studio “Mosaico”, prodotto da Janssen di Johnson & Johnson, erano riposte moltissime aspettative e gli esordi sembravano promettere bene. Nel 2019 era passato alla sperimentazione clinica di fase avanzata, coinvolgendo 3.900 volontari sieronegativi di età compresa tra 18 e 60 anni in Europa, Nord America e Sud America. Per l’Italia partecipavano l’Ospedale San Raffaele di Milano, l’Azienda Ospedaliero-Universitaria Policlinico di Modena e l’Istituto nazionale malattie infettive Spallanzani di Roma. Il nome dello studio, Mosaico, era legato alla composizione del vaccino che utilizzava sequenze di vari sottotipi del virus con l’obiettivo di indurre una risposta immunitaria universale.

La sperimentazione si è rivelata sicura ed efficace nell’indurre nell’uomo produzione di anticorpi, ma inefficace nel prevenire l’infezione. «La risposta immunitaria c’è», ribadisce Guido Poli, «ma non riesce a eliminare il virus quando la persona è già infettata e non riesce attraverso la vaccinazione a sviluppare anticorpi o altre forme di difese immunitarie in grado di prevenire l’infezione».
Poli definisce l’HIV come un nuovo tipo di virus per l’uomo: un retrovirus. «La maggioranza delle cellule infettate muore, con meccanismi complessi, mentre una piccola minoranza sopravvive e perpetua l’infezione. Se il paziente assume farmaci antiretrovirali tutto è tenuto sotto controllo, ma nel momento in cui, per qualsiasi motivo, sospende la terapia, il virus nel giro di due-tre settimane rimbalza esattamente ai livelli di replicazione precedenti». Ed ecco il primo ostacolo fondamentale per un vaccino: la risposta immunitaria è in grado di contenere, ma non di eliminare il virus.
Una luce in fondo al tunnel: lo studio RV 144
Secondo Poli esiste comunque un valido punto di partenza se si vuole invertire la rotta nella ricerca. Ed è lo studio RV 144 del 2009, ad opera del Walter Reed US Army Institute, l’istituto militare di sviluppo di vaccini e farmaci finalizzati alla protezione dei soldati americani in missione. Effettuato in Thailandia su 14.000 volontari a basso rischio di infezione, lo studio «ha combinato due approcci che individualmente avevano fallito». Per tale ragione «non era nato sotto i migliori auspici, tant’è che il budget a disposizione era molto limitato». Sta di fatto che per la prima volta si è osservata una protezione dall’infezione nel 30% delle persone vaccinate nei primi tre anni post-vaccinazione. «Se applicata per un attimo alla pandemia da coronavirus, una protezione al 30% sarebbe stata buttata nel cestino – ammette Poli – Ma nel campo dell’HIV è stata un’autentica luce che si è accesa improvvisamente».
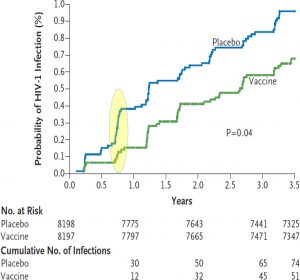
Anziché cercare di replicare quella strada, gli studi seguenti come Imbokodo, effettuato da Janssen, gli stessi di Mosaico, hanno «cambiato una serie di caratteristiche degli immunogeni, cioè delle componenti del vaccino, e cambiato il soggetto passando da una popolazione a basso rischio di infezione, come quella thailandese, a una popolazione ad alto rischio di infezione come quella africana con abitudini sessuali diverse». E il risultato è stato che «quelli che dovevano essere degli studi di conferma, ed eventualmente di estensione di questi risultati parzialmente positivi, sono falliti del tutto».
SARS-CoV-2 e HIV: due virus diversi, un’unica lezione
Un ulteriore spunto di riflessione potrebbe arrivare proprio dalla pandemia da Covid-19 «che non era completamente nuova, nel senso che la prima vera epidemia pericolosa e mortale causata da un coronavirus è stata quella da SARS nel 2002-2003». In meno di un anno, quest’ultima ha contagiato 8100 persone in 32 Paesi, particolarmente la Cina e il Canada, provocando quasi 800 morti, prima di spegnersi senza nemmeno lasciare il tempo di completare gli studi su vaccini e farmaci. «Però questa esperienza non è stata buttata via», fa notare Poli. Ha infatti permesso un importante investimento nello sviluppo dei vaccini a RNA Messaggero, la molecola chiave per contrastare il Covid-19.
E così dallo scoppio della pandemia, in undici mesi si è arrivati ad avere dei vaccini che hanno salvato una grossa fetta di umanità «grazie al fatto che avevamo 15 anni di esperienza nella tecnologia dei vaccini a RNA Messaggero. Questo per dire che non si inventa niente dall’oggi al domani». Per Poli è infatti necessario compiere un atto di umiltà nella ricerca e capire perché quello studio fatto in Thailandia ha funzionato mentre tutti gli altri hanno fallito. In altre parole, ripartire dal 2009 «perché c’era un punto di partenza nuovo ed è stato scavalcato per fare qualcosa di diverso e di teoricamente migliore che non si è rivelato tale».
Una scoperta importante: il caso del paziente di Berlino
Il 2009 è un anno fondamentale, perché oltre all’unico studio vaccinale che ha prodotto un risultato importante, c’è stato il primo caso al mondo di una persona guarita dall’infezione di HIV: il famoso “paziente di Berlino”, Timothy Ray Brown, un americano sieropositivo che viveva in Germania. Durante un trapianto di cellule staminali di midollo osseo per curare una leucemia, i medici selezionarono un donatore non solo compatibile dal punto di vista immunologico, ma anche in grado di dotare il paziente di un nuovo sistema immunitario resistente al virus residuale nel suo corpo, grazie a una mutazione genetica del recettore CCR5. Tim Brown è infatti vissuto oltre 10 anni (morì a causa della sua leucemia iniziale) senza più assumere farmaci antiretrovirali e senza evidenza di replicazione di HIV. Dal paziente di Berlino se ne sono aggiunti altri quattro, fino ad arrivare all’ultimo caso, di poche settimane fa, del paziente di Dusseldorf.
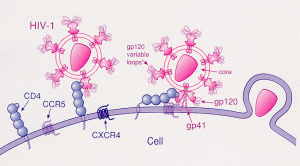
«Questo approccio funziona e può essere proposto alle persone che devono subire una simile operazione», sostiene Poli, «anche se chiaramente non è una terapia che può essere estesa alla popolazione generale, perché non puoi proporre un trapianto di staminali o comunque trovare dei donatori compatibili per tutti». Questo tipo di intervento, estremamente invasivo e applicabile in pochissimi casi, rappresenta comunque un’iniezione di fiducia a fronte dell’insuccesso nella ricerca di un vaccino. La malattia si può battere. E non è uno dei pochi passi in avanti che sono stati compiuti negli ultimi quarant’anni.
Una nuova malattia, una nuova consapevolezza

L’AIDS, la malattia mortale causata dal virus HIV, è emersa per la prima volta il 5 giugno 1981. I medici del CDC di Atlanta notarono dei casi sospetti di polmonite in cinque persone nate con un sistema immunitario normale. Grazie in particolare al lavoro di Robert Gallo, si scoprì che era una zoonosi virale, ovvero un virus di origine animale, passato nella popolazione umana attraverso gli scimpanzé in Congo. L’HIV venne così isolato nel 1983 e identificato inequivocabilmente come l’unica causa dell’AIDS (sindrome da immunodeficienza acquisita) nel 1984; l’allora segretario americano alla Salute, Margaret Heckler, dichiarò che entro due anni sarebbe stato trovato un vaccino in grado di prevenire l’infezione da HIV o la sua evoluzione in AIDS. Ad oggi, nel 2023, questo vaccino non è ancora arrivato. È però mutato l’atteggiamento nei confronti della malattia.
«Nella prima fase i pazienti erano letteralmente considerati degli appestati», ricorda Poli, che in quegli anni ha lavorato anche negli Stati Uniti con Anthony Fauci: «Gli spazi degli ambulatori ricordavano i film sugli zombi, un aspetto veramente tragico del malato di AIDS perché non c’era alcuna cura». Di fronte a un virus così letale quanto inedito venne a crearsi una situazione di panico generale, che colpì specificatamente la comunità omosessuale, tanto che per anni si continuò a parlare di “malattia dei gay”. L’AIDS in realtà poteva colpire chiunque, senza distinzioni di età e orientamento sessuale, anche attraverso il sangue. È il caso di Ryan White, uno studente minorenne che contrasse il virus a seguito di una trasfusione infetta, venendo per questo allontanato da scuola. La sua battaglia lo rese un simbolo della lotta all’AIDS e dell’integrazione delle persone sieropositive.

In pochi anni arrivarono le prime vittime nel mondo dello spettacolo: l’attore Rock Hudson, morto nel 1985, il leader dei Queen Freddie Mercury, nel 1991, e il cestista Magic Johnson, costretto al ritiro dopo essere risultato sieropositivo seppure non malato di AIDS. Tutti casi che segnarono il passaggio a una fase di maggiore consapevolezza. Nel 1993 Jonathan Demme girò Philadelphia, uno dei primi film a trattare in maniera esplicita il tema. Per la sua interpretazione di Andrew Beckett, un avvocato sieropositivo allontanato dal proprio studio legale, Tom Hanks ricevette l’Oscar al miglior attore.
Gli sviluppi in Italia
Nel nostro Paese si ricorda, dal 1990 al 2010, l’esperienza del Programma Nazionale contro l’AIDS «che conteneva importanti finanziamenti per la ricerca». È la testimonianza di Guido Poli: «Io sono rientrato dagli Stati Uniti grazie a questo programma nazionale, che fra tante ottime cose ha promosso anche della buona informazione». Con l’avvento della terapia antiretrovirale che permette di recuperare chiunque venga infettato «i nostri politici hanno però deciso che l’AIDS non era più un’emergenza e chiuso questo programma di finanziamento».

Oggi in Italia ci sono circa 150.000 persone infettate. Grazie ai progressi della scienza, vivono un’esistenza praticamente identica a quella delle persone non infettate, ma sono comunque condannate ad assumere farmaci per il resto della loro vita, con tutti i rischi e costi per la salute che questo comporta. «Sono circa 3.000 le nuove infezioni all’anno, concentrate soprattutto a Milano, Roma e in Lombardia», conclude Poli, «e di queste la metà riguarda persone già in fase avanzata di malattia che hanno già infettato diverse altre persone, quindi il problema non è mai scomparso dalla nostra società».
Salti nel buio: gli ostacoli della ricerca
Nel campo del giornalismo, un importante contributo proviene da Jon Cohen, corrispondente della rivista Science e autore di alcuni libri-inchiesta. Nel 2001 ha pubblicato “Shots in the Dark: The Wayward Search for an AIDS Vaccine”, dove indaga sui problemi e ostacoli della ricerca. «L’idea è nata da un mio articolo del 1989 per il Washington City Paper che aveva lo stesso titolo», svela Cohen: «Così ho iniziato a vendere una proposta di libro, e l’editore ha accettato di rimandare il lavoro fino all’arrivo sul mercato di un vaccino contro l’AIDS. Quando il presidente Bill Clinton, nel 1997, ha fissato a riguardo un obiettivo di dieci anni, mi sono reso contro che era una follia e ho deciso di anticipare i tempi».

Il libro è stato ottimamente accolto dalla critica e dalla comunità scientifica. Agli Science Journalism Awards 2002 è stato premiato con il massimo dei voti. Ma dalla pubblicazione, avvenuta oltre vent’anni fa, la ricerca ha continuato a registrare fallimenti: «Mosaico aveva sperato di perseguire la diversità virale con molti antigeni, ma era chiaro che dopo l’insuccesso di Imbokodo, che era uno studio simile, non avrebbe funzionato. La sfida principale per la ricerca sul vaccino contro l’HIV è che pochi esseri umani sviluppano naturalmente un’immunità protettiva contro l’infezione, poiché il virus si integra con il nostro DNA e può rimanere dormiente nel nostro genoma. Invece con il SARS-CoV-2, che non si integra, il sistema immunitario può eliminare il virus senza che vi siano genomi virali residui».
Cohen riconosce che «l’avvento di trattamenti antiretrovirali sicuri ed efficaci, ha salvato milioni di vite e risparmiato molte sofferenze». Ma i progressi procedono ancora troppo lentamente «perché l’industria preferisce andare cauta visto i rischi legati agli ultimi fallimenti. Siamo stati fortunati con il SARS-CoV-2, in quanto è un virus facile da fermare con il sistema immunitario. L’HIV attacca proprio cellule immunitarie che ci proteggono dai virus e, come ho detto, si nasconde nel genoma. È un nemico difficile. Questo è il punto della questione».
