
Venerdì 8 dicembre la Food and Drug Administration (FDA) americana ha approvato due nuove terapie geniche contro l’anemia falciforme, una malattia debilitante del sangue. Una di queste prevede – una prima storica volta – l’editing genetico. Finora l’unica soluzione utilizzata, con successo variabile, è stato il trapianto di midollo osseo da un donatore compatibile. Ma solo un quinto dei soggetti è in grado di trovare una corrispondenza efficace. Ora si apre così una nuova frontiera nella medicina, e una strada alternativa per i milioni di persone affette dall’anemia.
Cos’è l’anemia falciforme
Nota anche come drepanocitosi (SCD), l’anemia falciforme è una malformazione genetica ereditaria dell’emoglobina, la proteina – presente nei globuli rossi – che trasporta l’ossigeno. Questa, infatti, è presente in una sua forma anomala nota come di tipo S. I globuli che contengono alte quantità di emoglobina S tendono a deformarsi, perdendo la loro forma tipica a disco e la loro flessibilità. E andando ad assumere una conformazione a mezzaluna. Da qui il nome ‘falciforme’.
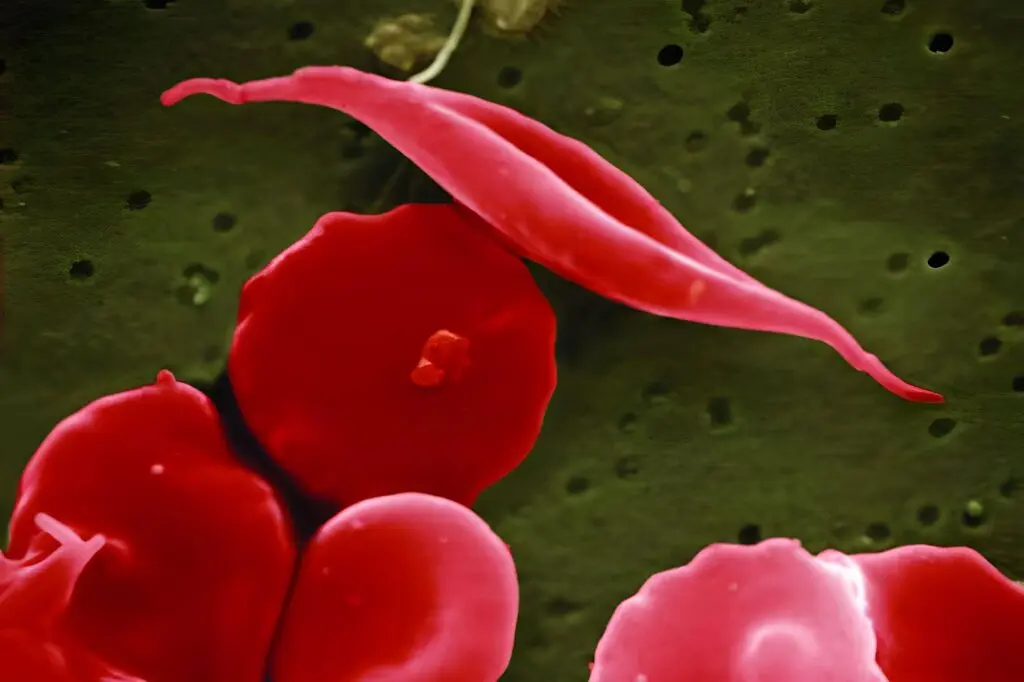
Le cellule deformate sono fragili, con un elevato tasso di rottura. Non solo. La rigidità delle cellule falciformi impedisce loro di muoversi nei vasi sanguigni. Questo blocca il flusso ematico e, di conseguenza, riduce o interrompe la circolazione di ossigeno. Ciò comporta nei pazienti forti dolori e danni a reni, cervello e ossa. Molto comune ma pericoloso per gli anemici è il danneggiamento della milza, l’organo che contribuisce a combattere le infezioni. Ma la drepanocitosi può arrivare anche a causare insufficienza renale o cardiaca.
La SCD è molto comune soprattutto le persone di origine africana o afroamericana. Si calcola che circa i 10% dei soggetti di tale ascendenza possieda una copia del gene falciforme, mentre lo 0,3% sviluppa l’effettiva malattia.
Come funzionano le nuove terapie
L’anemia è dovuta alla presenza di un solo gene, a livello del cromosoma 11. Da qui l’idea di agire direttamente sul tratto in questione tramite Casgevy, come sarà etichettato il trattamento di editing genetico. Questo è stato sviluppato congiuntamente da Vertex Pharmaceuticals di Boston e CRISPR Therapeutics of Switzerland, che nel 2021 vinsero il premio Nobel per la Chimica proprio per la ricerca nel campo della modificazione del genoma.

Il farmaco sarebbe somministrato una tantum tramite una procedura di trapianto di cellule staminali in cui le cellule del paziente sono state modificate per ridurre l’espressione del gene responsabile. Casgevy è già stato testato su 44 soggetti con crisi vaso-occlusive ricorrenti. In tutti, ha portato una netta diminuzione – e talvolta un’eliminazione – degli episodi di ostruzione dei capillari.
L’altra terapia approvata dalla FDA prende il nome di Lyfgenia. Sviluppata da Bluebird, si tratta di una terapia genica lentivirale. In poche parole, utilizza un virus innocuo per inserire un gene specifico nelle cellule staminali di un paziente in modo da favorire la produzione di emoglobina non anomala. In entrambi i casi, le cure hanno liberato la stragrande maggioranza dei pazienti da gravi crisi di dolore. I trattamenti sono per ora approvati per individui dai 12 anni in su.
Le prime reazioni alla novità
«Il potenziale di questi prodotti nel trasformare la vita dei pazienti affetti da anemia falciforme è enorme». Peter Marks, direttore del Centro per la valutazione e la ricerca biologica della FDA, ne è sicuro. Un passo in avanti enorme soprattutto per gli Stati Uniti, dove la drepanocitosi colpisce oltre 100mila persone. «Mi prendo cura dei bambini affetti da SCD da oltre 30 anni e aspettavo che accadesse qualcosa del genere da molto tempo», è il commento di Lewis Hsu, direttore medico della Sickle Cell Disease Association of America.

Prima dell’approvazione, molti pazienti su cui le terapie sono state testate hanno fornito la loro testimonianza alla FDA. «Pianificare a lungo termine significava pianificare un mondo senza che io potessi sostenere la mia famiglia. Ora, quei piani a lungo termine includono me». Eliminare o diminuire il dolore, per permettere alle persone di tornare a vivere. Finora erano necessarie frequenti trasfusioni di sangue, lunghi periodi in ospedale e l’assunzione di tre tipi di oppioidi come sedativi. Come ha raccontato Victoria Gray, la prima a ricevere il trattamento sperimentale Casgevy. «Sono finalmente libera da crisi dolorose. Era come se un camion mi avesse investito e un fulmine mi avesse colpito allo stesso tempo».
I dubbi e le perplessità sulle cure
Ma l’innovazione, come sempre, è accompagnata da qualche velo di dubbio. Per quanto riguarda Casgevy e Lyfgenia, i veli sono molteplici. A partire dal breve tempo di monitoraggio per quanto riguarda la loro efficacia: il primo test è stato effettuato nel 2019. «Non sappiamo ancora quali saranno gli effetti a lungo termine. Non abbiamo seguito i pazienti abbastanza a lungo, solo un paio d’anni», ha detto John DiPersio, direttore del Centro per l’immunoterapia genica e cellulare presso la Washington University School of Medicine di St. Louis.

Uno dei problemi è che entrambe le terapie sono procedure intensive che si svolgono nell’arco di mesi. Ai pazienti devono essere prima raccolte le cellule del midollo osseo. Un laboratorio, poi, le elabora trattandole con CRISPR o con il virus. Gli individui, poi, devono sottoporsi a pesanti sessioni di chemioterapia per creare sufficiente spazio nel midollo osseo. Solo allora potrà avvenire l’infusione di cellule modificate. E non mancano gli effetti collaterali. I più comuni per ora sono stati bassi livelli di piastrine e globuli bianchi, nausea, dolori muscolo-scheletrici e addominali e vomito.
Il costo non è per tutti
Tutto questo è possibile solo se i soggetti riescono a reperire un centro medico che effettivamente offra queste nuove terapie all’avanguardia. Finora Vertex ha autorizzato solo nove strutture a fornire il suo trattamento, e ne prevedono fino a un massimo di 50 in totale. Bluebird ha l’accordo con solo 27 centri. Numeri troppo bassi per una delle malattie genetiche più diffuse. Ma giustificati dall’elevatissimo costo di queste cure. Il listino prezzi recita: per Casgevy 2,2 milioni di dollari a paziente, per Lyfgenia addirittura 3,1 milioni. Evidentemente, ben pochi possono permettersele.
«Se ogni paziente affetto da anemia falciforme nel Missouri venisse curato, lo stato non potrebbe permetterselo», è la preoccupazione di John DiPersio. I principali centri medici hanno già ammesso che sarebbero in grado di prendere in cura solo pochissimi individui. «Non possiamo trattarne più di 10 all’anno», ha affermato Jean-Antoine Ribeil, direttore clinico del Centro di eccellenza per l’anemia falciforme del Boston Medical Center.
E sorgerebbero problematiche anche in ambito assicurativo. Negli Stati Uniti il sistema sanitario è quasi del tutto privato. Chi ha accesso alle strutture è tendenzialmente assicurato. Ma fino a che cifra sarebbero disposte a coprire le compagnie assicurative? Cui si aggiunge un altro tema. Le cellule staminali ‘vivranno per sempre’, quindi se Casgevy o Lyfgenia provocano danni genetici questi rimarranno. Come ha chiosato DiPersio: «Ne sono entusiasta, ma è un’arma a doppio taglio».
